spectraalanalyse en atoommodel van Bohr
Isaac Newton
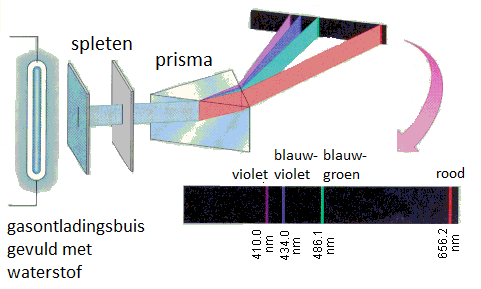
Zonlicht nemen we waar als 'wit' licht. Maar toen Isaac Newton een bundel zonlicht liet invallen op een glazen prisma, zag hij een continue kleurenreeks, die hij spectrum noemde. Deze kleurenreeks ontstaat omdat de brekingsindex afhankelijk is van de golflengte van het licht. Het spectrum is continu omdat zonlicht wit is: het straalt licht uit van alle golflengtes.
Later ondervond men dat licht van gloeiende materialen heel andere spectra vormde. Die eigenschap leerde men gebruiken om de aard van het materiaal te onderzoeken. Zo kan men b.v. uit de analyse van het licht van een ster veel leren over de samenstelling van deze ster. We spreken dan van spectraalanalyse.
Bohr gebruikte deze techniek om zijn atoommodel te formuleren.

continu spectrum van zonlicht

gasontladingsbuizen
tl-lampen en spaarlampen zijn gasontladingsbuizen, gevuld met een gas, waardoor een elektrische stroom gestuurd word. Afhankelijk van het gebruikte gas, heeft het licht een andere kleur. Door het licht te laten invallen op een prisma kan je de verschillende spectra tonen.
We weten dat de energie-inhoud van licht afhankelijk is van de golflengte (m.a.w. de kleur van het licht). De alanyse van de spectra gaf Bohr informatie over de energie-inhoud van het licht. Hieruit ontwikkelde hijzijn atoommodel.
Niels Bohr
In een atoom bezit elk elektron een potentiële energie (evenredig met zijn afstand tot de kern) en een kinetische energie (afhankelijk van zijn snelheid).
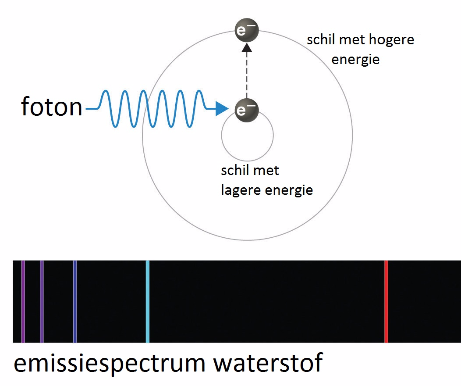
Je kunt energie toevoegen aan een atoom door het b.v. te verhitten. Vooral de elektronen aan de buitenzijde van de elektronenwolk zullen zich verder van de kern verwijderen. Maar deze toestand is onstabiel. Een atoom streeft naar een zo laag mogelijke energie-inhoud en de elektronen zullen terugkeren naar hun grondtoestand: een positie met lagere potentiële energie. Bij dit terugvallen wordt het teveel aan energie afgegeven onder de vorm van licht.
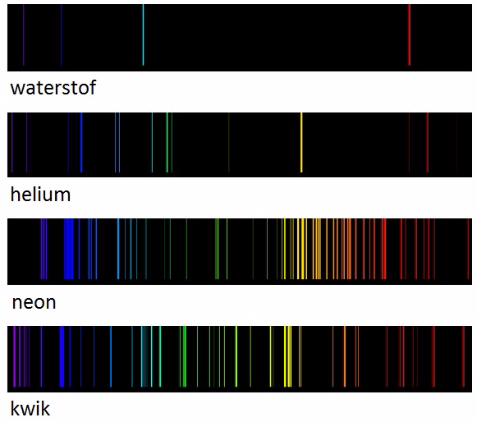
In tegenstelling tot het zonlicht is dit licht niet wit, maar gekleurd. Het kleurenspectrum is niet continu. Het is geconcentreerd in een aantal lijnen met een bepaalde kleur. Dit lijnspectrum blijkt typisch voor elk materiaal. We kunnen hieruit dus eigenschappen afleiden van het materiaal.
emissiespectra van verschillende materialen
Hieronder zie je de emissiespectra van verschillende materialen.
Op de webpagina emissiespectra en het PSE kan je het emissiespectrum van een willekeurig materiaal tone door in het PSE op een willekeurig element klikken.
emissiespectra en het atoommodel van Bohr
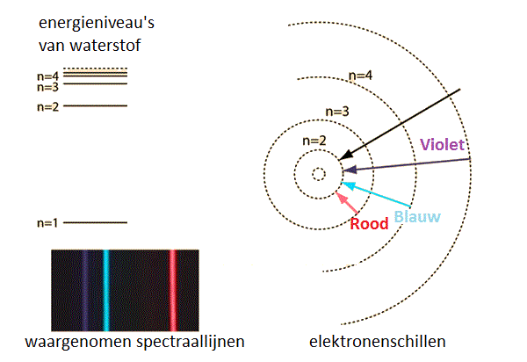
Voor Bohr toonde de emissiespectra aan dat elektronen zich niet op willekeurige afstanden van de kern kunnen bevinden. Elke lijn van het emissiespectrum heeft een bepaalde kleur en dus een welbepaalde golflengte en energie-inhoud. De energie-afgifte door middel van licht (m.a.w. door een foton) komt dus overeen met een welbepaald energieverschil.
Bohr besluit dat de elektronen zich enkel op 7 welbepaalde energie-niveau's kunnen bevinden, concentrisch rond de kern. Deze energieniveau's noemt hij schillen.