2_2 gebogen
water
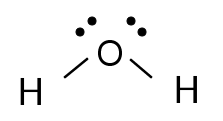
In een molecule wordt een zuurstofatoom 8O (2-6) omgeven door twee waterstofatomen 1H (1).
De K-schil van waterstof wordt opgevuld tot twee elektronen en de L-schil van zuurstof tot acht elektronen (octetconfiguratie).
Lewisstructuur
Twee van de zes valentie-elektronen van het zuurstofatoom vormen een gemeenschappelijk elektronenpaar met een waterstofelektron. Twee vrije elektronenparen blijven over en zijn niet betrokken bij de binding.
De Lewisstructuur van ammoniak ziet er uit als volgt:
ruimtelijke structuur
De twee waterstofatomen vormen geen lijnstuk met het zuurstofatoom als midden. De twee vrije elektronenparen van het zuurstofatoom spelen speelt geen rol bij de binding, maar wel bij de vorm van een molecuul. Ook deze vrije elektronenparen zorgen voor afstoting in de molecule. Hierdoor vormen ze voor een gebogen structuur.
We kunnen water ook voorstellen als volgt: