eerste ionisatie-energie
begrip
De eerste inonisatie-energie is de energie, nodig om het minst sterk gebonden elektron te onttrekken aan een gasvormig atoom. De waarde hangt af van de afstand van het elektron tot de kern: hoe verder het elektron van de kern verwijderd is, hoe gemakkelijker het elektron kan ontsnappen aan de kern.
De aantrekkingskracht van de kern op elektronen verkleint met de afstand tot de kern. Om verder van de kern gelegen elektronen te onttrekken aan een atoom is minder energie nodig, de op een verder van de kern gelegen elektron is kleiner. De eerste ionisatie-energie is kleiner.
eerste ionisatie-energie en PSE
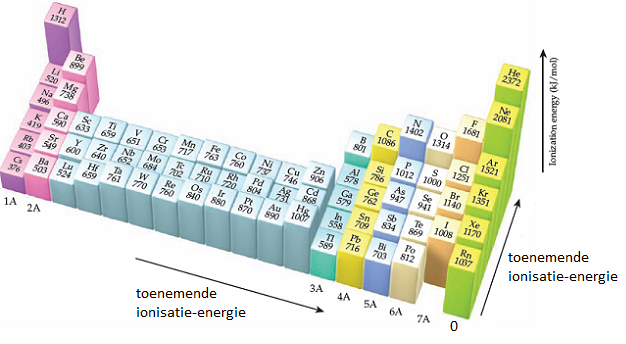
In de opbouw van het PSE kan je de elektronenconfiguratie terugvinden. In het PSE moet je dus ook per groep en periode het verloop van de eerste ionisatie-energie kunnen terugvinden. Een eerste indicatie krijg je al in volgende grafiek die voor alle elementen van het PSE de eerste ionisatie-energie toont.
- Verticale lijnen scheiden de perioden.
- Elementen van eenzelfde groep hebben dezelfde kleur
In volgend applet kan je per groep en per periode het verloop van de eerste ionisatie-energie volgen door de groene punten te verslepen.
eerste ionisatie-energie per groep
- Binnen een groep neemt het aantal bezette schillen toe van boven naar onder. De buitenste elektronen bevinden zich verder van de kern.
- Binnen een groep neemt dus de eerste ionisatie-energie af van boven naar onder.
eerste ionisatie-energie per periode
- Binnen een periode neemt de kernlading toe van links naar rechts en daarmee ook de aantrekkingskracht op de elektronen. Het atoom wordt kleiner.
- Binnen een periode neemt dus ook de eerste ionisatie-energie toe van links naar rechts. De waarde neemt toe naarmate het aantal elektronen in de buitenste schil 8 benadert. Dit wordt duidelijk wanneer we in de grafiek b.v. periodes 2 en 3 uitvergroten.
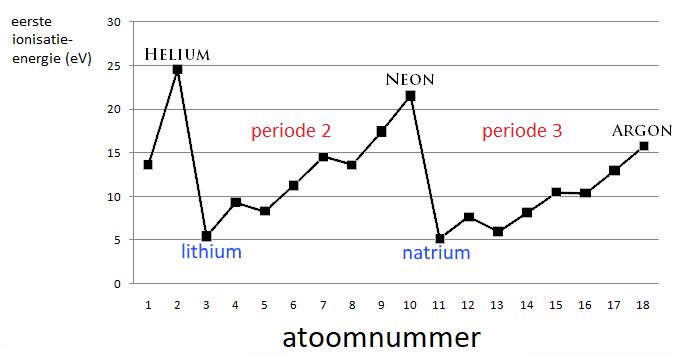
Maak je van het PSE een 3d staafdiagram dan kan je mooi per groep en per periode het verloop van de eerste ionisatie-energie volgen