3_2 T-vormig
chloorfluoride
In een molecule wordt een chlooratoom 17Cl (2-8-7) omgeven door drie fluoratomen 9F (2-7).
De M-schil van chloor wordt opgevuld tot tien elektronen en de L-schil van fluor tot acht elektronen (octetconfiguratie).
Lewisstructuur
Drie valentie-elektronen van het chlooratoom vormen elk een gemeenschappelijk elektronenpaar met een fluorelektron. De Lewisstructuur van chloortrifluoride ziet er uit als volgt:
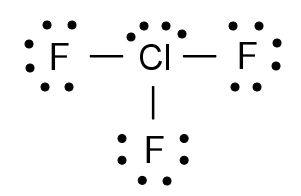
ruimtelijke structuur
De twee vrije elektronenparen van het chlooratoom zorgen voor bijkomende afstoting en verhinderen een octaëderstructur. De vier atomen vormen een t-vormige configuratie.
We een kunnen een molecule chloortrifluoride ook voorstellen als volgt: