4_0 tetraëder
methaan
In een molecule wordt een koolstofatoom 6C (2-4) omgeven door vier waterstofatomen 1H (1).
De K-schil van waterstof wordt opgevuld tot twee elektronen en de K-schil van koostof tot acht elektronen (octetconfiguratie).
Lewisstructuur
De vier valentie-elektronen van het koolstofatoom vormen elk een gemeenschappelijk elektronenpaar met een waterstofelektron. De Lewisstructuur van methaan ziet er uit als volgt:
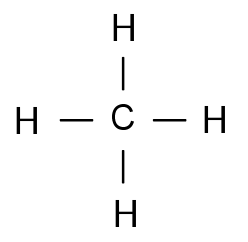
ruimtelijke structuur
De vier waterstofatomen vormen de hoekpunten van een octaëder met het koolstofatoom als zwaartepunt.
We een kunnen een methaanmolecule ook voorstellen als volgt: